帕金森病中α-突触核蛋白的角色至关重要,该蛋白是神经元内特征性路易小体的主要组成部分。由于α-突触核蛋白既具有高度的水溶性也显著地与磷脂膜结合,其在神经病理学中的功能双重性引起了广泛关注,与磷脂膜结合的α-突触核蛋白通过调控神经递质的释放来维持神经系统的稳定性,但其在膜表面的过度累积和聚集则可能引起膜结构的破坏,导致神经元损伤。α-突触核蛋白在细胞内浓度高(微摩尔量级),而在细胞外极低(纳摩尔量级),这种差异对其功能与稳定性提出了独特的科学问题。
近日,bdy必定赢官网/北京凝聚态物理国家研究中心的陆颖团队与bdy必定赢官网上海有机化学研究所的刘聪团队联合发布了一项研究成果。此项研究主要运用单分子荧光成像技术,深入探索了帕金森病相关的关键蛋白——α-突触核蛋白在带负电的磷脂膜表面的聚集机制,解释了该蛋白如何在高和低两个极端浓度下都正常行使功能。该团队长期致力于膜蛋白动力学的研究,基于单个受体对多个供体的荧光共振能量转移原理,他们在单分子荧光成像技术上取得了诸多高精度动力学测量的突破。
通过精确控制实验条件和精细的数据分析,研究团队发现α-突触核蛋白在磷脂膜表面的聚集过程中呈现自限性特点。这一发现不仅加深了科学界对帕金森病α-突触核蛋白行为的理解,也为未来针对这一神经退行性疾病的治疗策略开发提供了潜在的新靶点。研究结果显示,α-突触核蛋白在膜表面的聚集体在形成初期就显示出其大小和密度的自我限制特性,这一机制可能是控制其在膜表面累积的关键因素。研究团队发现,即使在较高蛋白浓度下,α-突触核蛋白的聚集体在磷脂膜表面的大小和密度均有限,呈现出明显的“自限性”特征。这一现象可能与蛋白在聚集体中的结合-解离动态平衡有关,这种平衡由单体与环境中的蛋白进行动态交换实现,从而形成一个稳定的聚集体大小。
该研究不仅在理解帕金森病的发病机理上提供了新的见解,也为针对此疾病的未来治疗策略提供了可能的新靶点。本研究的共同第一作者包括松山湖材料实验室的马东飞副研究员、上海交通大学的博士研究生章沈庆、华南师范大学与松山湖材料实验室联合培养的博士研究生徐思瑶。共同通讯作者为刘聪研究员、李明研究员及陆颖研究员。合作团队还包括上海交通大学李丹教授、华南师范大学的陈同生教授等。此项研究受到了国家自然科学基金委、科技部、bdy必定赢官网、广东省基础与应用基础研究基金委员会、上海市科学技术委员会等资助。研究成果已在《Science Advances》杂志发表,题为“Self-limiting multimerization of α-synuclein on membrane and its implication in Parkinson’s diseases”。
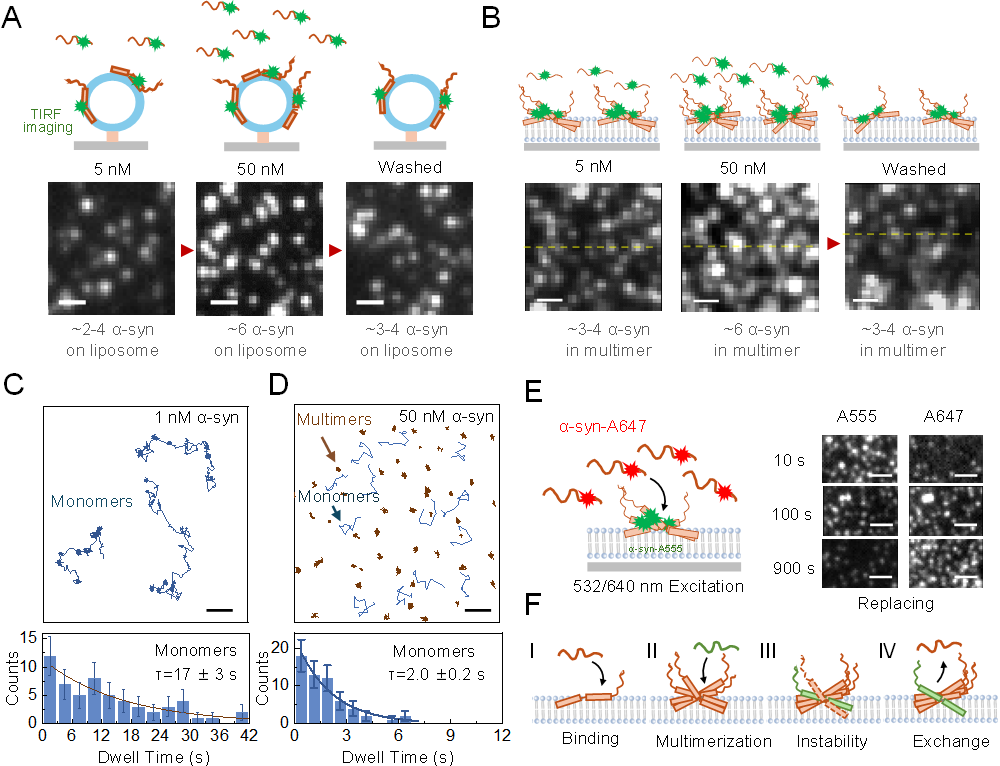
图 α-突触核蛋白在膜表面的自限制吸附及其分子机制。
(A). α-突触核蛋白在囊泡上的有限吸附。 (B). α-突触核蛋白在平面磷脂膜表面的自限性聚集。 (C). 1 nM浓度下,α-突触核蛋白单体在平面膜表面的运动轨迹(上图)及其在膜表面的驻留时间(下图)。(D). 50 nM浓度下,α-突触核蛋白单体(蓝色)及聚集体(棕色)在平面膜表面的运动轨迹(上图)及单体在膜表面的驻留时间(下图)。(E). Alexa Fluor 647标记的α-突触核蛋白对膜表面Alexa Fluor 555标记的α-突触核蛋白聚集体内部单体的替换。(F). α-突触核蛋白通过聚集体内部单体的动态交换限制其自身生长的机制。

